Les biopsies liquides ou la recherche de mutation sur ADN tumoral circulant : une réalité au LaboCita
C’est par la découverte par Mandel en 1948 de fragments d’ADN acellulaires libérés dans la circulation sanguine que le développement de nouveaux tests diagnostiques sur ADN libre circulant (ADNlc) sont rendus possibles aujourd’hui dans la pratique clinique. A commencer par le diagnostic anténatal : en 1997, Lo et al.ont pu démontrer la présence d’ADN fœtal libre circulant dans le plasma et le sérum des femmes enceintes. Cette observation majeure a ainsi, en quelques années, ouvert la voie aux diagnostics prénatals sur ADN fœtal tels que le génotypage RHD et la détection des principales aneuploïdies fœtales (NIPT).
En particulier, dès 2002, le laboratoire de la Citadelle s’est révélé précurseur pour ce type d’analyse sur plasma maternel en offrant la possibilité d’une immunoprophylaxie ciblée anti-D sur base du génotypage RHD fœtal suivie, en 2013, par la mise à disposition du test NIPT sur l’ADN fœtal dédié au diagnostic prénatal non-invasif des anomalies chromosomiques majeures (13, 18 et 21).
Ce sont ces développements analytiques sur l’ADN libre circulant fœtal qui ont contribué à la «re-découverte» de l’ADN tumoral circulant (ADNtc) et à ré-évaluer son intérêt en oncologie. L’ADNtc, à distinguer des cellules tumorales circulantes (CTC) plus difficiles et onéreuses à isoler, est un des composants de l’ADN libre présent dans le plasma et le sérum humains. Sa première description date de 1977, lorsque Leon et al. observent que l’ADN véhiculé dans le sérum de patients cancéreux est en quantité supérieure à celle relevée chez les sujets sains. Il faut attendre 1994 pour que Sorenson démontre l’origine tumorale de l’ADN circulant chez des patients atteints de cancer pancréatique en détectant la même mutation KRAS au niveau du plasma et de la tumeur primitive. Par la suite, les publications se sont multipliées en dévoilant l’énorme potentiel de la détection de l’ADNtc dont les applications en tant que biomarqueur tumoral sont aujourd’hui disponibles au sein du laboratoire de la Citadelle.
Origine et avantages de l’ADNtc
L’ADN tumoral circulant (ADNtc) ne représentant qu’une fraction de l’ADN total libre circulant (ADNlc), sa concentration varie énormément suivant le type de tumeur et son stade (< 1 % pour les stades précoces). Il est réparti sous la forme de petits fragments d’ADN en mono, di et surtout tri-nucléosomes (fig. 1) et sa demi-vie ne dépasse pas deux heures après résection tumorale ce qui en fait un témoin très sensible du statut néoplasique.
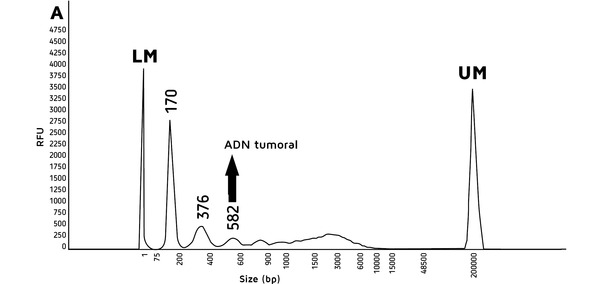
Figure 1
En effet, quelle que soit l’origine invoquée pour l’ADN tumoral circulant, à savoir l’apoptose, la nécrose ou la sécrétion active des cellules tumorales, son grand avantage réside dans sa représentativité plus globale et dynamique de la masse tumorale malgré l’hétérogénéité ou la multiplicité des lésions néoplasiques. De plus, contrairement aux biopsies de tissus solides, l’évaluation de l’ADNtc ne requiert qu’une prise de sang moins invasive et plus rapide (fig. 2) surtout chez les patients atteints de métastases hépatiques ou porteurs de lésions difficilement accessibles (pancréatiques, pulmonaires, ...).
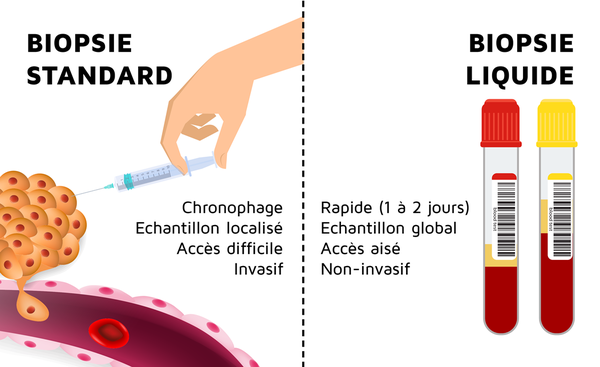
Figure 2
Utilité en pratique
Quatre types d’applications majeures en oncologie sont possibles à partir des biopsies liquides à savoir, diagnostique, pronostique, prédictive et de suivi thérapeutique. Les applications diagnostiques et de dépistage sur ADNtc sont encore en plein essor pour les diagnostics des cancers très peu symptomatiques tels que les cancers pancréatiques. En associant, par exemple, des marqueurs classiques (CA19.9, …) et la détection de mutations sur ADNtc, une sensibilité élevée peut être atteinte indépendamment de l’imagerie médicale. Des études prometteuses sont aussi en cours. Elles portent sur le dépistage des cancers prostatiques, coliques, mammaires et ovariens, et il ne fait aucun doute que des tests en tandem, incluant la détection de mutations (BRCA1/2, APC, ...) dans l’ADNtc, se révèleront fort utiles pour les populations à haut risque, prédisposées à développer ces cancers. En ce qui concerne le diagnostic prédictif en oncologie, la médecine de précision se base sur l’identification de biomarqueurs moléculaires tumoraux pouvant servir de cibles thérapeutiques ou de révélateurs de résistance aux traitements conventionnels ou ciblés. Dans cette approche thérapeutique, un suivi longitudinal s’impose aussi car les marqueurs oncogéniques ont la propriété d’évoluer avec les traitements administrés (fig. 3).
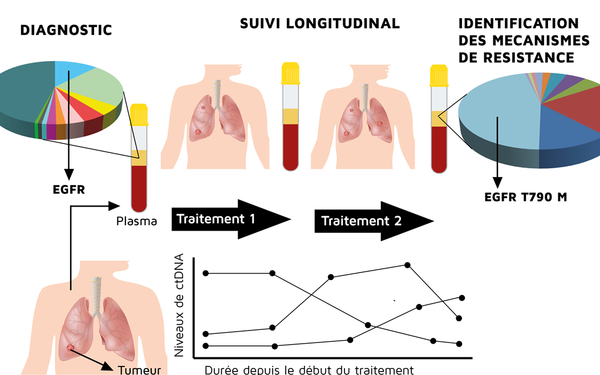
Figure 3
A titre d’exemple, parmi ces altérations moléculaires, les mutations EGFR sont activement recherchées dans les cancers bronchiques non à petites cellules (CBNPC) de stade avancé car elles prédisent une sensibilité au traitement par inhibiteurs de tyrosine kinase (anti-TKI), supérieure à la chimiothérapie, et un meilleur pronostic. Mais dans la pratique, cette recherche sur biopsie tissulaire n’est pas toujours réalisable et échoue parfois à détecter les mutations de résistance en raison de l’hétérogénéité tumorale. Suite aux récentes études cliniques (dont Lux-lung 3 et 6) portant sur le traitement des CBNPC avancés, l’usage des biopsies liquides comme alternative au prélèvement tissulaire a été validé avec une haute concordance pour la détection des mutations avant, pendant et après le traitement par ani-TKI (fig. 3). Un autre exemple de l’usage des biopsies liquides dans la sélection de la thérapie ciblée s’applique aux cancers recto-coliques métastasés (fig. 4).
Figure 4
La littérature ainsi que plusieurs études récentes - RASANC et CAPRI-GIOM - font état d’un délai d’attente diminué et d’une très bonne concordance entre le dépistage du statut RAS wild type répondeur au traitement anti-EGFR sur plasma et celui sur biopsies hépatiques chez les patients avec métastases hépatiques. De plus, que ce soit dans le CBNPC avancé ou le cancer recto-colique métastasé, toutes ces études ont montré que l’évolution du taux d’ADNtc détecté au cours des traitements avait une valeur predictive sur l’efficacité du traitement ciblé. En outre, il a été démontré que, pour tous les types de cancers y compris hématologiques, le seul fait d’identifier de l’ADNtc chez les patients après leur traitement par chirurgie, chimiothérapie, hormonothérapie ou immunothérapie constituait un facteur indépendant de pronostic de survie sans progression et de survie globale. C’est le cas notamment des mélanomes malins, illustrés par la figure 5, les CBNPC ou les cancers colorectaux avec instabilité microsatellitaire (MSI) traités par immunothérapie.
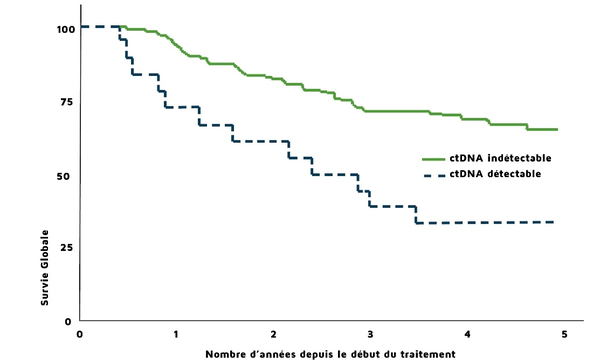
Figure 5
Conclusion
Etant donné les grandes avancées dans le traitement ciblé des cancers et la grande diversité de l’arsenal thérapeutique en oncologie, il n’est donc pas surprenant qu’un test aussi rapide, flexible et non invasif tel que l’analyse de mutations sur biopsie liquide ait été rapidement accrédité et implanté en routine au laboratoire du CHR Liège, au plus grand bénéfice des patients.
Auteurs :
Dr SIBILLE et Dr Senterre, Ph Bio de Marchin, Dr Dumoulin, Dr Gustin, Dr Bustin, Dr Weber, Dr Delhougne, Dr Frère et Dr Minon
Nos experts







